0 引言
传统的肺癌细胞病理图像诊断主要通过病理医生对细胞形态、数量、分化程度等特征进行分析,得出诊断结果。近年来,随着患病人数的增加,医生的工作负担不断加重,且部分地区还存在病理医生短缺的情况。因此,对肺癌细胞病理图像辅助诊断系统的研究具有重要的实际意义,将先进的计算机技术和细胞学专家的诊断经验结合,可在一定程度上解决当前医学上癌细胞诊断的困扰,减少病理学专家的工作量及人为的影响,在很大程度上提高肺癌早期筛查的效率,降低肺癌患者死亡率[1 ] 。
关于细胞图像的疾病诊断,首先需要对肺癌细胞病理图像进行分割,分析细胞形态、尺寸、核质比等特征,判断是否存在癌变。因此细胞图像分割是疾病诊断中至关重要的环节,其效果将直接影响后续诊断的准确率。
在肺部细胞病理图像中,细胞颗粒往往存在形态各异、大小不一、边界模糊、重叠交织、细胞区域与背景区域对比不明显等问题,加大了细胞图像分割的难度。
目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等。2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法。上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果。
近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型。由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割。但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞。分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] 。
因此,针对肺部细胞病理图像背景复杂、细胞重叠交织的数据特点,结合现有方法,提出一种新的结构进行肺部细胞的分割。首先,采用Attention U-Net 模型进行细胞初分割,获取细胞区域;然后依据面积、周长、圆度特征进行区域判别,对于判别结果是重叠细胞的区域,采用基于瓶颈检测与椭圆拟合的再分割模型进行重叠细胞分割,得到单个细胞单元。
1 数据预处理
本文以肺部细胞病理图像为研究对象,共200张图像,每张图像内含多个细胞。针对图像中存在噪声、细胞边界不清晰的问题,采用双边滤波(bilateral filtering)算法进行图像去噪,在去除噪声的同时尽可能地保留细胞边缘信息。在此基础上,对图像进行锐化,突出边缘特征,加大目标物与背景的对比度。
1.1 双边滤波去噪
双边滤波是基于高斯滤波方法提出的一种非线性滤波器[16 ] 。相对于高斯滤波,双边滤波对滤波权系数进行了优化,同时考虑空间信息和像素值相似度,将高斯函数和图像亮度信息相乘,再与图像信息做卷积运算,这样就能在滤波的同时考虑图像中的边缘信息,使得高斯滤波后模糊的边缘信息可以保持清晰,并且使图像边缘更加平滑。双边滤波的表达式为:
g ( i , j ) = ∑ k , l f ( k , l ) w ( i , j , k , l ) ∑ k , l w ( i , j , k , l ) ( 1 )
其中,g(i,j)为双边滤波后位置(i,j)的像素值;f 为邻域像素值,(k,l)表示邻域内像素位置;权重系数w(i,j,k,l)为空间域高斯核与灰度域高斯核的乘积,表达式为:
w ( i , j , k , l ) =
exp ( − ( i − k ) 2 + ( j − l ) 2 2 σ d 2 − | | f ( i , j ) − f ( k , l ) | | 2 2 σ r 2 ) ( 2 )
其中,i、j为g的像素强度,k、l为f的像素强度,σd 为度量空间相似性的高斯核标准差,σr 为灰度相似性的高斯核标准差。从式(2)中可以发现,滤波器的滤波效果由σd 、σr 决定,σd 值越大,图像越模糊;而σr 值越大,邻域内像素间关联性越小。本文经过多次实验对比发现,当滤波区间半径 r 取值为3,σd 取值为4,σr 取值为3时,滤波效果最好。
在分割肺部细胞病理图像的过程中,常因为细胞边缘模糊造成欠分割,因此在进行分割步骤前对图像进行拉普拉斯锐化处理[17 ] ,突出边缘特征,加大目标轮廓与背景的对比度。设f为输入的原图像,则拉普拉斯算子可表示为:
∇ 2 f = 4 f ( x , y ) − f ( x − 1 , y ) −
f ( x , y + 1 ) − f ( x + 1 , y ) − f ( x , y − 1 ) ( 3 )
由式(3)可知,将中心点像素灰度值分别与上下左右4个点的像素灰度值作差,差值总和即拉普拉斯滤波值。
本文选用四邻域拉普拉斯模板矩阵与原图像做卷积运算,根据式(4)更新图像像素灰度值:
g ( x , y ) = { f ( x , y ) − ∇ 2 f ( x , y ) , ∇ 2 f < 0 f ( x , y ) + ∇ 2 f ( x , y ) , ∇ 2 f ≥ 0 ( 4 )
其中,f(i,j)为原图像像素灰度值,g(i,j)为锐化后像素灰度值。
2 细胞分割方法
2.1 基于Attention U-Net的细胞初分割
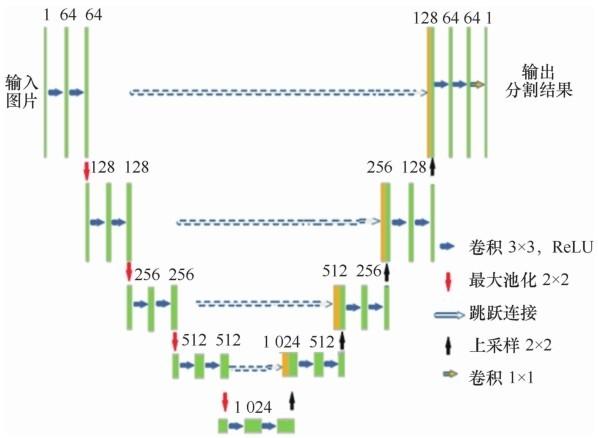
Attention U-Net是由Oktay O等人[18 ] 在2018年国际计算机视觉与模式识别(conference on computer vision and pattern recognition,CVPR)会议上提出的,用于解决胰腺CT(computed tomography)分割任务,Attention U-Net的网络架构如图1 所示。
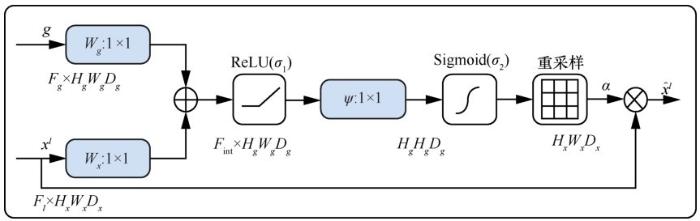
该网络架构在U-Net基础上引入注意力模块,将编码器中的特征图与解码器中经过上采样的特征图一同输入注意力模块中,进行像素权重图的重建,消除跳跃连接中不相关的特征响应,突出与任务相关的特征。其中,注意力模块的结构如图2 所示。其中,xl 和g代表特征图,F代表通道,H、W 代表图像高度及宽度,D 代表卷积层,σ1 表示ReLU激活函数,σ2 表示Sigmoid激活函数。首先对上采样得到的特征图g和通过跳跃连接传过来的特征图xl 执行 1×1 的卷积操作,减少特征图的通道数;然后再将卷积操作后的两特征图合并,经过ReLU 函数、1×1 卷积、Sigmoid 函数,计算得出注意力系数α。最后,将特征图xl 与注意力系数α相乘,得到权重图,进行上采样操作。
图1
对于肺部细胞病理图像的分割问题,应该更多地关注细胞的边界,因此采用引入注意力机制的语义分割模型来抑制不相关背景区域的特征响应,聚焦于细胞边界,突出更有分辨性的特征,提高分割准确率。
2.2 连通区域判别
对于细胞初分割实验得到的所有连通区域,通过提取连通区域的面积、周长、圆度信息进行判别,区分单个细胞与重叠细胞。判别条件主要包括两部分,必须同时满足才可将区域判定为重叠区域。条件一是面积大于阈值或周长大于阈值;条件二是圆度小于阈值。其中,对于面积(周长)特征阈值的选取,首先计算图像内所有连通域面积(周长)值,从小到大排序,然后将数值发生第二次突变时的初始值与变化值的平均数作为阈值(如图3 所示,纵轴代表各连通域的面积域值,横轴代表图像中的连通域)。与之相比,圆度阈值的选取有所不同。圆度特征值取值区间为[0,1],值越接近 1,说明细胞形态越完整,越接近于完整细胞。因此,对所有圆度数据进行降序排列,将第一次突变时的初始值与变化值的平均数作为阈值。
图2
图3
本文选取 50 张肺部细胞病理图像,分别计算每张图像中面积、周长、圆度阈值,对其求平均,所得值即判别阈值。其中,面积阈值为 385,周长阈值为75,圆度阈值为0.88。
2.3 基于瓶颈检测与椭圆拟合的细胞再分割
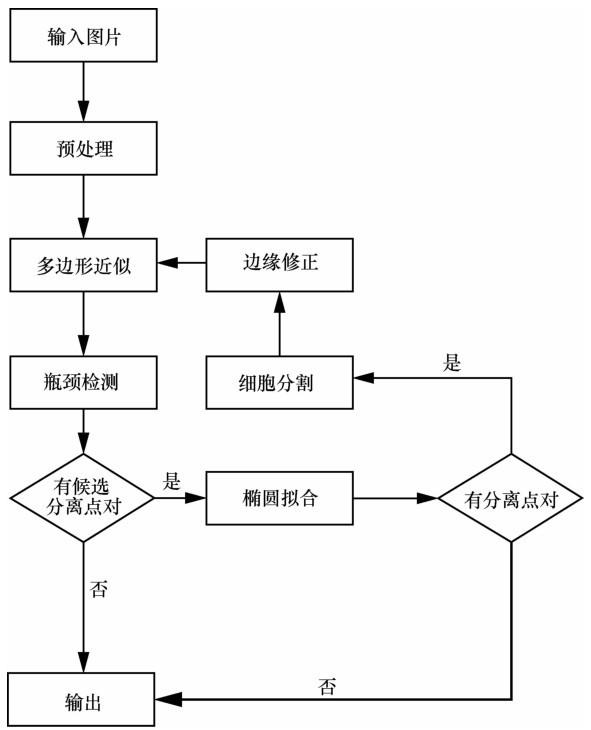
重叠细胞的分割问题主要分为两部分,一是寻找正确的分离点对,二是进行边缘修正。细胞再分割流程如图4 所示。
综合细胞重叠整体形态可以看出分离点对往往存在于整体轮廓最狭窄的部位,类似于瓶颈,如图5 (a)所示。因此,对筛选出的重叠细胞区域采用瓶颈检测算法[19 ] 寻找正确分离点对。
对于细胞轮廓上两个特征点pa 和pb ,瓶颈率e(pa ,pb )的定义为:
e ( p a , p b ) = dist ( p a , p b ) min { length ( p a , p b ) , length ( p b , p a ) } ( 5 )
其中,dist(pa ,pb ) 表示两点间的欧氏距离, length(pa ,pb )表示顺时针方向 pa 到 pb 的边界长度,length(pb ,pa )表示逆时针方向pa 到pb 的边界长度。若得到的瓶颈率e(pa ,pb )小于阈值Te ,则这两个特征点可被判定为一组候选分离点对。通常,对于标准圆形,瓶颈率的最小值为2/π,考虑到肺部细胞病理图像单元存在椭圆形及其他不规则形状,所设阈值应小于2/π。因此,本文将 Te 设为1/2。若最后在该区域内未得到候选分离点对,则表明该区域只包含一个细胞。
图4
在获取到所有候选分离点对后,还需要对其进一步筛选,得到正确分离点对。首先,将所有分离点对按e值从小到大排列。将细胞轮廓从第一组候选分离点对处断开,得到两段残缺轮廓L1 和L2 ,分别进行椭圆拟合。令S1 和S2 分别表示由L1 和L2 拟合得到的椭圆面积,r为由这两个面积计算得到的最大面积比,若r>Tr ,则表示两个拟合后的椭圆面积相差较大,即当前候选分离点对不是正确分离点对。其中,Tr 为预先设置的阈值,结合数据特征,本文将阈值Tr 设置为5。
为了完整地得到细胞轮廓,在获得分离点对后,还需要进行边缘修正操作。具体步骤如下。
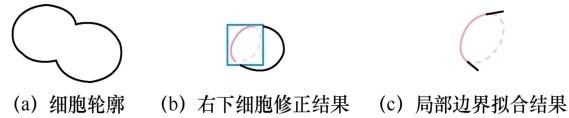
步骤一:在分离点对pa (x1 ,y1 )和pb (x2 ,y2 )边缘处沿相反时针方向各选取一段局部边界,如图5 (b)中的黑色实线所示。
步骤二:对选取的边界采用最小二乘法进行椭圆拟合,应用式(6)对拟合的椭圆进行约束,确保椭圆经过pa (x1 ,y1 )和pb (x2 ,y2 )两点。其中(x1 ,y1 )和(x2 ,y2 )是两个分离点。拟合后的椭圆边界如图5 (c)中的红色线所示。
{ a x 1 2 + b x 1 y 1 + c y 1 2 + d x 1 + e y 1 + f = 0 a x 2 2 + b x 2 y 2 + c y 2 2 + d x 2 + e y 2 + f = 0 } ( 6 )
步骤三:从pa 、pb 两点处将拟合的椭圆断开,得到两段弧线,分别与pa 、pb 间的分离边缘形成封闭区域,计算区域的固性,选取值较大的区域所对应的弧线段为修补边界,如图5 (b)红色实线所示。图5 中的红色虚线代表椭圆拟合修正的效果。
图5
3 实验结果及分析
3.1 数据预处理
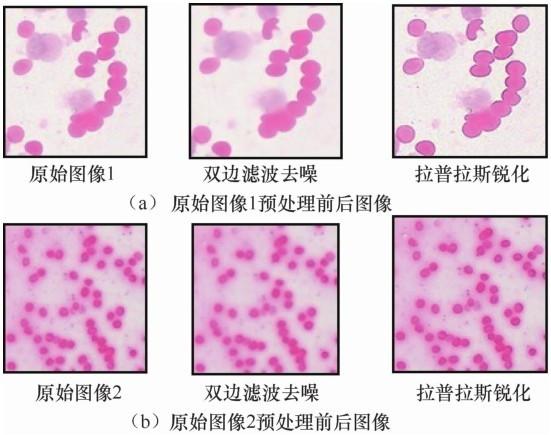
本文首先对肺部细胞病理图像进行预处理,消除噪声、加大细胞与背景的对比度。之后通过翻转、旋转等操作对数据及标签进行扩充,增加数据量。预处理前后图像如图6 所示。
图6
从图6 中可以看出,本文的预处理方法能够使细胞边缘特征更加突出,加大了目标与背景区域的对比度。
3.2 细胞初分割
在网络模型训练过程中,初始学习率设为0.0001,训练样本数量(epoch)设为20,批处理大小(batch size)设为1,α设为0.25,γ设为2。为了评估提出的粗分割模型的分割效果,将引入注意力机制的Attention U-Net 模型与原模型以及 Micro-Net、HoVer-Net 在肺部细胞病理图像数据集上做对比实验,并使用相似(Dice)系数、交并比(intersection of union,IoU)从分割精度方面对两种模型的性能进行评判。不同方法的分割结果见表1 。
由表1 可以看出,Attention U-Net模型Dice系数为93.95%,IoU为86.92%。与其他3个模型相比,本文方法在肺部细胞病理图像上具有更优的分割性能。
3.3 区域判别
对数据进行初分割后,图像中会包含多个连通域。本文通过提取连通域面积、周长、圆度等特征进行单个细胞与重叠细胞的判别。将判别结果为单个细胞的区域标注为0,将重叠细胞区域标注为1。后续只对标注为1的区域进行再分割,避免发生过分割现象。
precision= TP TP + FP ( 7 )
其中,TP代表区域标注与预测类别均为1的区域个数,FP代表区域标注类别为0、预测类别为1的区域个数。实验表明,判别模型准确率为97%,能有效地区分单个细胞与重叠细胞。
3.4 重叠细胞分割
细胞重叠有多种状态,本文主要研究以下几种重叠情况的分割问题,即细胞间不存在两层以上重叠交织的情况,如图7 所示。各步骤结果示意图如图8 所示。
图7
为了对分割算法进行有效评估,在此选用分割准确率AC为评价指标,如式(8)所示:
AC = TP TP + SP + ME + AD ( 8 )
其中,TP代表正确分割的细胞数目;SP代表一个细胞被误分割成两个细胞的个数;ME 则表示两个细胞或多个细胞未被分割,而是被融合成一个细胞单元的情况;AD代表非目标区域误分割的个数。
图8
为了验证本文方法的有效性,在肺部细胞病理图像数据集上选用了 Otsu、K-means、基于距离变换的Watershed算法同本文模型做比较,结果见表2 ,不同方法的实验效果如图9 所示。
从表2 可以看出,前两种方法分割准确率较低,具体原因在于不能有效地对粘连或重叠的细胞进行分割,造成这种现象的原因通常是细胞重叠面积过大或者目标区域与背景区域过于接近,难以分辨;Watershed算法虽能正确地分割出大部分细胞,但也容易造成细胞过分割,这是由于该方法不能有效地筛选正确分离点对。与之相比,本文方法在肺部细胞病理图像数据集上具有较好的表现,分割准确率为94.05%,能实现串联重叠细胞的准确分割,并进行边界修补。
4 结束语
本文以肺部细胞病理图像为研究对象,针对图像边缘模糊、存在噪声的数据特点,采用双边滤波及拉普拉斯锐化对图像进行预处理,去除噪声,突出边缘细节特征,加大目标与背景的对比;对于预处理后的数据,采用引入注意力机制的U-Net模型进行初分割,得到多个封闭连通域,根据形状特征区分单个细胞区域与重叠细胞区域;对重叠细胞区域进行轮廓提取,采用瓶颈检测方法寻找正确分离点对,采用椭圆拟合算法进行边缘修正,实现肺部细胞病理图像的分割。从结果上看,本文方法在肺部细胞病理图像上的分割准确率为94.05%,具有较好的分割结果,能够准确分割出单个细胞与重叠细胞。但从实际数据的结果出发,还存在一定不足,当细胞重叠过于严重、产生多层覆盖的情况时,分割效果不是很好。因此,面对重叠程度比较严重的细胞团,如何提高分割精度将会是下一步工作的重点。
图9
参考文献
View Option
[1]
FERNANDES K , CHICCO D , CARDOSO J S ,et al . Supervised deep learning embeddings for the prediction of cervical cancer diagnosis
[J]. PeerJ Computer Science , 2018 ,4:e154.
[本文引用: 1]
[2]
SUN H F , YANG J H , FAN R B ,et al . Stepwise local stitching ultrasound image algorithms based on adaptive iterative threshold harris corner features
[J]. Medicine , 2020 ,99 (37 ): e22189 .
[本文引用: 1]
[3]
HSU W Y , LU C C , HSU Y Y . Improving segmentation accuracy of CT kidney cancer images using adaptive active contour model
[J]. Medicine , 2020 ,99 (47 ): e23083 .
[本文引用: 1]
[4]
何安良 , 程兴保 , 廖龙长 ,等 . 耦合H-minima与数学形态学的分水岭遥感图像分割方法
[J]. 东华理工大学学报(自然科学版) , 2020 ,43 (4 ): 396 -400 .
[本文引用: 1]
HE A L , CHENG X B , LIAO L C ,et al . An improved watershed method for remote sensing image segmentation coupling H-minima with mathematical morphology
[J]. Journal of East China University of Technology (Natural Science) , 2020 ,43 (4 ): 396 -400 .
[本文引用: 1]
[5]
CHO M . Performance comparison of two ellipse fitting-based cell separation algorithms
[J]. Journal of Information and Communication Convergence Engineering , 2015 ,13 (3 ): 215 -219 .
[本文引用: 1]
[6]
KOYUNCU C F , AKHAN E , ERSAHIN T ,et al . Iterative H-minima-based marker-controlled watershed for cell nucleus segmentation
[J]. Cytometry Part A , 2016 ,89 (4 ): 338 -349 .
[本文引用: 1]
[7]
廖苗 , 赵于前 , 曾业战 ,等 . 基于支持向量机和椭圆拟合的细胞图像自动分割
[J]. 浙江大学学报(工学版) , 2017 ,51 (4 ): 722 -728 .
[本文引用: 1]
LIAO M , ZHAO Y Q , ZENG Y Z ,et al . Automatic segmentation for cell images based on support vector machine and ellipse fitting
[J]. Journal of Zhejiang University (Engineering Science) , 2017 ,51 (4 ): 722 -728 .
[本文引用: 1]
[8]
杨秀杰 , 李法平 . 基于曲率和活动轮廓模型的重叠细胞分割算法
[J]. 西南师范大学学报(自然科学版) , 2018 ,43 (4 ): 41 -47 .
[本文引用: 1]
YANG X J , LI F P . Overlapping cells segmentation algorithm based on curvature and active contour model
[J]. Journal of Southwest China Normal University (Natural Science Edition) , 2018 ,43 (4 ): 41 -47 .
[本文引用: 1]
[9]
何国生 , 施露露 , 邹爽爽 ,等 . 基于自适应阈值的间充质干细胞分割方法研究
[J]. 电子测量与仪器学报 , 2019 ,33 (6 ): 18 -23 .
[本文引用: 1]
HE G S , SHI L L , ZOU S S ,et al . Research on mesenchymal stem cells segmentation based on adaptive threshold
[J]. Journal of Electronic Measurement and Instrumentation , 2019 ,33 (6 ): 18 -23 .
[本文引用: 1]
[10]
FABIJAŃSKA A . Segmentation of corneal endothelium images using a U-Net-based convolutional neural network
[J]. Artificial Intelligence in Medicine , 2018 ,88 : 1 -13 .
[本文引用: 1]
[11]
NASR-ESFAHANI E , RAFIEI S , JAFARI M H ,et al . Dense pooling layers in fully convolutional network for skin lesion segmentation
[J]. Computerized Medical Imaging and Graphics , 2019 ,78:101658.
[本文引用: 1]
[12]
SAQIB Q , HAI J , RAN Z ,et al . A variant form of 3D-UNet for infant brain segmentation
[J]. Future Generation Computer Systems , 2020 ,108 (7 ): 613 -623 .
[本文引用: 1]
[13]
SHIMAA E-B , AHMAD A-K , MAHA S . A two-stage framework for automated malignant pulmonary nodule detection in CT scans
[J]. Diagnostics , 2020 ,10 (3 ): e131 .
[本文引用: 1]
[14]
LIU Z . Construction and verification of color fundus image retinal vessels segmentation algorithm under BP neural network
[J]. The Journal of Supercomputing , 2021 ,77 (7 ): 7171 -7183 .
[本文引用: 1]
[15]
崔文成 , 张鹏霞 , 邵虹 . 基于深度可分离卷积网络的皮肤镜图像病灶分割方法
[J]. 智能科学与技术学报 , 2020 ,2 (4 ): 385 -393 .
[本文引用: 1]
CUI W C , ZHANG P X , SHAO H . Dermoscopic image lesion segmentation method based on deep separable convolutional network
[J]. Chinese Journal of Intelligent Science and Technology , 2020 ,2 (4 ): 385 -393 .
[本文引用: 1]
[16]
王涛 , 陈凡胜 , 苏晓锋 . 基于各向异性双边滤波红外背景抑制方法研究
[J]. 湖南大学学报(自然科学版) , 2018 ,45 (2 ): 119 -126 .
[本文引用: 1]
WANG T , CHEN F S , SU X F . Research of infrared background suppression method based on anisotropic bilateral filtering
[J]. Journal of Hunan University (Natural Sciences) , 2018 ,45 (2 ): 119 -126 .
[本文引用: 1]
[17]
王浩 , 张叶 , 沈宏海 ,等 . 图像增强算法综述
[J]. 中国光学 , 2017 ,10 (4 ): 438 -448 .
[本文引用: 1]
WANG H , ZHANG Y , SHEN H H ,et al . Review of image enhancement algorithms
[J]. Chinese Optics , 2017 ,10 (4 ): 438 -448 .
[本文引用: 1]
[18]
OKTAY O , SCHLEMPER J , FOLGOC L L ,et al . Attention U-Net:learning where to look for the pancreas
[J]. arXiv preprint , 2018 ,arXiv:1804.03999.
[本文引用: 1]
[19]
WANG H , ZHANG H , RAY N . Clump splitting via bottleneck detection and shape classification
[J]. Pattern Recognition , 2012 ,45 (7 ): 2780 -2787 .
[本文引用: 1]
Supervised deep learning embeddings for the prediction of cervical cancer diagnosis
1
2018
... 传统的肺癌细胞病理图像诊断主要通过病理医生对细胞形态、数量、分化程度等特征进行分析,得出诊断结果.近年来,随着患病人数的增加,医生的工作负担不断加重,且部分地区还存在病理医生短缺的情况.因此,对肺癌细胞病理图像辅助诊断系统的研究具有重要的实际意义,将先进的计算机技术和细胞学专家的诊断经验结合,可在一定程度上解决当前医学上癌细胞诊断的困扰,减少病理学专家的工作量及人为的影响,在很大程度上提高肺癌早期筛查的效率,降低肺癌患者死亡率[1 ] . ...
Stepwise local stitching ultrasound image algorithms based on adaptive iterative threshold harris corner features
1
2020
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
Improving segmentation accuracy of CT kidney cancer images using adaptive active contour model
1
2020
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
耦合H-minima与数学形态学的分水岭遥感图像分割方法
1
2020
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
耦合H-minima与数学形态学的分水岭遥感图像分割方法
1
2020
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
Performance comparison of two ellipse fitting-based cell separation algorithms
1
2015
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
Iterative H-minima-based marker-controlled watershed for cell nucleus segmentation
1
2016
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
基于支持向量机和椭圆拟合的细胞图像自动分割
1
2017
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
基于支持向量机和椭圆拟合的细胞图像自动分割
1
2017
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
基于曲率和活动轮廓模型的重叠细胞分割算法
1
2018
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
基于曲率和活动轮廓模型的重叠细胞分割算法
1
2018
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
基于自适应阈值的间充质干细胞分割方法研究
1
2019
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
基于自适应阈值的间充质干细胞分割方法研究
1
2019
... 目前图像分割领域常用的传统分割方法主要包括阈值分割法[2 ] 、主动轮廓法[3 ] 、分水岭方法[4 ] 、椭圆拟合[5 ] 等.2016年,Koyuncu C F等人[6 ] 提出了一种基于迭代H最小值的标记分水岭算法,用于荧光显微图像的细胞分割;2017年,廖苗等人[7 ] 针对血液图像中细胞重叠问题提出了一种基于支持向量机(support vector machine,SVM)和椭圆拟合的分割方法;2018年,杨秀杰等人[8 ] 针对宫颈细胞重叠问题,提出了一种基于曲率和活动轮廓模型的分割方法;2019年,针对干细胞图像分割问题,何国生等人[9 ] 提出了结合光晕矫正的自适应阈值分割方法.上述方法在各自数据中均能实现细胞分割,具有较好的分割性能,但传统算法普遍依赖于手工设计特征,特征选取的好坏将直接影响分割结果的优劣,因此算法性能易受主观因素的影响,缺乏泛化性,且当细胞图像背景复杂、特征差异大、边界不清晰时,上述方法难以取得准确性高的分割效果. ...
Segmentation of corneal endothelium images using a U-Net-based convolutional neural network
1
2018
... 近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型.由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割.但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞.分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] . ...
Dense pooling layers in fully convolutional network for skin lesion segmentation
1
2019
... 近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型.由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割.但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞.分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] . ...
A variant form of 3D-UNet for infant brain segmentation
1
2020
... 近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型.由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割.但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞.分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] . ...
A two-stage framework for automated malignant pulmonary nodule detection in CT scans
1
2020
... 近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型.由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割.但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞.分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] . ...
Construction and verification of color fundus image retinal vessels segmentation algorithm under BP neural network
1
2021
... 近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型.由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割.但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞.分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] . ...
基于深度可分离卷积网络的皮肤镜图像病灶分割方法
1
2020
... 近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型.由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割.但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞.分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] . ...
基于深度可分离卷积网络的皮肤镜图像病灶分割方法
1
2020
... 近年来,随着深度学习技术的不断发展,许多模型被应用于医学图像领域,如2018年,Fabijańska A[10 ] 针对角膜内皮图像提出一种基于U-Net的卷积神经网络进行细胞分割;2019年,Nasr-Esfahani E等人[11 ] 提出一种改进的全卷积网络模型,用于解决皮肤病变区域的细胞分割问题;2020 年,Saqib Q等人[12 ] 提出了一种3D-UNet模型,用于解决磁共振成像(magnetic resonance imaging,MRI)婴儿脑部细胞分割问题;Shimaa E-B等人[13 ] 采用Deeplab模型对肺部细胞图像进行语义分割;2021年,Liu Z [14 ] 针对彩色眼底图像视网膜血管细胞分割问题提出了一种改进的反向传播(back propagation,BP)神经网络模型.由此可以看出,深度学习技术在医学图像中应用广泛,可被用于解决皮肤、MRI、视网膜图像以及细胞图像的分割问题,实现目标的自动分割.但上述模型在处理细胞分割任务上也存在一定弊端,当切片中的细胞存在重叠交织的情况时,难以分割出单个细胞.分割问题不仅是实现肺部细胞病理图像诊断的关键,也是计算机图像处理与模式识别领域的重要研究内容[15 ] . ...
基于各向异性双边滤波红外背景抑制方法研究
1
2018
... 双边滤波是基于高斯滤波方法提出的一种非线性滤波器[16 ] .相对于高斯滤波,双边滤波对滤波权系数进行了优化,同时考虑空间信息和像素值相似度,将高斯函数和图像亮度信息相乘,再与图像信息做卷积运算,这样就能在滤波的同时考虑图像中的边缘信息,使得高斯滤波后模糊的边缘信息可以保持清晰,并且使图像边缘更加平滑.双边滤波的表达式为: ...
基于各向异性双边滤波红外背景抑制方法研究
1
2018
... 双边滤波是基于高斯滤波方法提出的一种非线性滤波器[16 ] .相对于高斯滤波,双边滤波对滤波权系数进行了优化,同时考虑空间信息和像素值相似度,将高斯函数和图像亮度信息相乘,再与图像信息做卷积运算,这样就能在滤波的同时考虑图像中的边缘信息,使得高斯滤波后模糊的边缘信息可以保持清晰,并且使图像边缘更加平滑.双边滤波的表达式为: ...
图像增强算法综述
1
2017
... 在分割肺部细胞病理图像的过程中,常因为细胞边缘模糊造成欠分割,因此在进行分割步骤前对图像进行拉普拉斯锐化处理[17 ] ,突出边缘特征,加大目标轮廓与背景的对比度.设f为输入的原图像,则拉普拉斯算子可表示为: ...
图像增强算法综述
1
2017
... 在分割肺部细胞病理图像的过程中,常因为细胞边缘模糊造成欠分割,因此在进行分割步骤前对图像进行拉普拉斯锐化处理[17 ] ,突出边缘特征,加大目标轮廓与背景的对比度.设f为输入的原图像,则拉普拉斯算子可表示为: ...
Attention U-Net:learning where to look for the pancreas
1
2018
... Attention U-Net是由Oktay O等人[18 ] 在2018年国际计算机视觉与模式识别(conference on computer vision and pattern recognition,CVPR)会议上提出的,用于解决胰腺CT(computed tomography)分割任务,Attention U-Net的网络架构如图1 所示. ...
Clump splitting via bottleneck detection and shape classification
1
2012
... 综合细胞重叠整体形态可以看出分离点对往往存在于整体轮廓最狭窄的部位,类似于瓶颈,如图5 (a)所示.因此,对筛选出的重叠细胞区域采用瓶颈检测算法[19 ] 寻找正确分离点对. ...